TFRC
| Рецептор трансферрина 1 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
 1CX8 1CX8 | |||||||||||
| Доступные структуры | |||||||||||
| PDB | Поиск ортологов: PDBe, RCSB | ||||||||||
Список идентификаторов PDB 1CX8, 1DE4, 1SUV, 2NSU, 3KAS, 3S9L, 3S9M, 3S9N | |||||||||||
| Идентификаторы | |||||||||||
| Символ | TFRC ; CD71; T9; TFR; TFR1; TR; TRFR; p90 | ||||||||||
| Внешние ID | OMIM: 190010 MGI: 98822 HomoloGene: 2429 GeneCards: Ген TFRC | ||||||||||
| |||||||||||
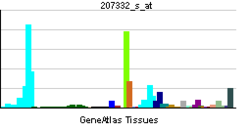
| Профиль экспрессии РНК | |||||||||||
 | |||||||||||
 | |||||||||||
| Больше информации | |||||||||||
| Ортологи | |||||||||||
| Вид | Человек | Мышь | |||||||||
| Entrez | 7037 | 22042 | |||||||||
| Ensembl | ENSG00000072274 | ENSMUSG00000022797 | |||||||||
| UniProt | P02786 | Q62351 | |||||||||
| RefSeq (мРНК) | NM_001128148 | NM_011638 | |||||||||
| RefSeq (белок) | NP_001121620 | NP_035768 | |||||||||
| Локус (UCSC) | Chr 3: 196.03 – 196.08 Mb | Chr 16: 32.61 – 32.63 Mb | |||||||||
| Поиск в PubMed | Искать | Искать | |||||||||
Рецептор трансферрина 1 (TfR1, CD71) — мембранный белок. Продукт гена человека TFRC.[1][2] Необходим для доставки железа от трансферрина в клетку.[3][4]
Структура

Рецептор трансферрина 1 является трансмембранным гликопротеином, состоит из двух мономеров, соединённых дисульфидной связью. Каждый мономер связывает одну молекулу голотрансферина, образуя комплекс Fe-Tf-TfR. Мономерный белок состоит из 760 аминокислот, молекулярная масса 84,87 кДа. Растворимый рецептор трансферина образуется при отщеплении N-концевого фрагмента (100 аминокислот), содержащего трансмембранный домен.
Функции
При связывании рецептора с трансферрином лиганд-рецепторный комплекс подвергается рецептор-опосредованному эндоцитозу[5] и попадает в специализированные эндосомы. Эндосомальное закисление приводит к высвобождению железа из комплекса Fe-Tf-TfR, а комплекс рецептора с апотрансферрином Tf-TfR возвращается на клеточную поверхность, где pH вновь становится нейтральной, что, в свою очередь, приводит к потере афинности и диссоциации апотрансферина от рецептора. Рецептор трансферрина играет ключевую роль в формировании эритроцитов и развитии нервной системы. Кроме трансферрина вторым лигандом рецептора трансферрина является т. н. белок наследственного гемохроматоза HFE, который конкурирует за связывание с рецептором.
Экспрессия регулируется уровнем железа в клетке, что опосредовано регуляторными белками IRP1 и IRP2.
Взаимодействия
TFRC взаимодействует с белками GABARAP[6] и HFE.[7][8]
См. также
- Трансферрины
- TFRC2
Примечания
- ↑ Sutherland R., Delia D., Schneider C., Newman R., Kemshead J., Greaves M. Ubiquitous cell-surface glycoprotein on tumor cells is proliferation-associated receptor for transferrin (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1981. — July (vol. 78, no. 7). — P. 4515—4519. — doi:10.1073/pnas.78.7.4515. — PMID 6270680. — PMC 319822.
- ↑ Rabin M., McClelland A., Kühn L., Ruddle F.H. Regional localization of the human transferrin receptor gene to 3q26.2----qter (англ.) // Am. J. Hum. Genet.[англ.] : journal. — 1985. — November (vol. 37, no. 6). — P. 1112—1116. — PMID 3002171. — PMC 1684729.
- ↑ Aisen P. Transferrin receptor 1 (англ.) // Int. J. Biochem. Cell Biol.[англ.] : journal. — 2004. — November (vol. 36, no. 11). — P. 2137—2143. — doi:10.1016/j.biocel.2004.02.007. — PMID 15313461.
- ↑ Moos T. Brain iron homeostasis (англ.) // Danish Medical Bulletin[англ.] : journal. — 2002. — November (vol. 49, no. 4). — P. 279—301. — PMID 12553165.
- ↑ Speeckaert, Marijn M.; Speeckaert, Reinhart; Delanghe, Joris R. Biological and clinical aspects of soluble transferrin receptor (англ.) // Critical Reviews in Clinical Laboratory Sciences[англ.] : journal. — 2010. — December (vol. 47, no. 5—6). — P. 213—228. — doi:10.3109/10408363.2010.550461. — PMID 21391831.
- ↑ Green F., O'Hare T., Blackwell A., Enns C.A. Association of human transferrin receptor with GABARAP (англ.) // FEBS Lett.[англ.] : journal. — 2002. — May (vol. 518, no. 1—3). — P. 101—106. — doi:10.1016/S0014-5793(02)02655-8. — PMID 11997026.
- ↑ Feder J.N., Penny D.M., Irrinki A., Lee V.K., Lebrón J.A., Watson N., Tsuchihashi Z., Sigal E., Bjorkman P.J., Schatzman R.C. The hemochromatosis gene product complexes with the transferrin receptor and lowers its affinity for ligand binding (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1998. — February (vol. 95, no. 4). — P. 1472—1477. — doi:10.1073/pnas.95.4.1472. — PMID 9465039. — PMC 19050.
- ↑ West A.P., Bennett M.J., Sellers V.M., Andrews N.C., Enns C.A., Bjorkman P.J. Comparison of the interactions of transferrin receptor and transferrin receptor 2 with transferrin and the hereditary hemochromatosis protein HFE (англ.) // J. Biol. Chem. : journal. — 2000. — December (vol. 275, no. 49). — P. 38135—38138. — doi:10.1074/jbc.C000664200. — PMID 11027676.
Ссылки
- CD71 (рецептор трансферина) (рус.)








