Natrijum sulfid
| Natrijum sulfid | |||
|---|---|---|---|
 | |||
 | |||
| Drugi nazivi | Dinatrijum sulfid | ||
| Identifikacija | |||
| CAS registarski broj | 1313-82-2  Y, Y, 1313-84-4 (pentahidrat) 1313-84-4 (nonahidrat) | ||
| PubChem[1][2] | 237873 | ||
| EINECS broj | 215-211-5 | ||
| UN broj | 1385 (anhidrat) 1849 (hidrat) | ||
| RTECS registarski broj toksičnosti | WE1905000 | ||
| Jmol-3D slike | Slika 1 | ||
| |||
| |||
| Svojstva | |||
| Molekulska formula | Na2S | ||
| Molarna masa | 78,0452 g/mol (anhidrat) 240,18 g/mol (nonahidrat) | ||
| Agregatno stanje | bezbojna, higroskopna čvrsta materija | ||
| Miris | pokvarena jaja | ||
| Gustina | 1,856 g/cm3 (anhidrat) 1,58 g/cm3 (pentahidrat) 1,43 g/cm3 (nonohidrat) | ||
| Tačka topljenja | 1176 °C (anhidrat) | ||
| Rastvorljivost u vodi | 12,4 g/100 mL (0 °C) 18,6 g/100 mL (20 °C) 39 g/100 mL (50 °C) | ||
| Rastvorljivost | nerastvoran u etru u maloj meri rastvoran u alkoholu | ||
| Struktura | |||
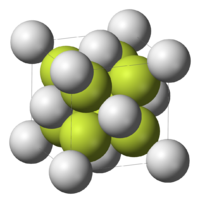
| Kristalna rešetka/struktura | Antifluorit (kubna), cF12 | ||
| Kristalografska grupa | Fm3m, No. 225 | ||
| Geometrija molekula | Tetraedralna (Na+); kubna (S2–) | ||
| Opasnost | |||
| Podaci o bezbednosti prilikom rukovanja (MSDS) | ICSC 1047 | ||
| EU-klasifikacija | Korozivan (C) Opasan za životnu sredinu (N) | ||
| EU-indeks | 016-009-00-8 | ||
| NFPA 704 |  1 3 1 | ||
| R-oznake | R31, R34, R50 | ||
| S-oznake | (S1/2), S26, S45, S61 | ||
| Tačka spontanog paljenja | >480 °C | ||
| Srodna jedinjenja | |||
| Drugi anjoni | Natrijum oksid Natrijum selenid Natrijum telurid | ||
| Drugi katjoni | Litijum sulfid Kalijum sulfid | ||
| Srodna jedinjenja | Natrijum hidrosulfid | ||
| Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje (25 °C, 100 kPa) materijala | |||
| Infobox references | |||
Natrijum sulfid je hemijsko jedinjenje sa formulom Na2S, ili češće u hidratnom obliku, Na2S·9H2O. Oba oblika su bezbojne u vodi rastvorne soli koje formiraju jake alkaline rastvore. Kad su izloženi vlažnom vazduhu, Na2S i njegovi hidrati emituju vodonik sulfid, koji ima zadah pokvarenh jaja. Neki komercijalni uzorci su specificirani kao Na2S·xH2O, gde je težinski procenat Na2S specificiran.
Struktura
Na2S poprima antifluoritnu strukturu,[3][4] što znači da Na+ centeri zauzimaju mesta fluorida u CaF2 poretku, a veći S2− zauzimaju mesta Ca2+. U rastvoru se soli disociraju. Dianjon S2− nije prisutan u značajnim količinama u vodi. Sulfid je suviše jaka baza da koegzistira sa vodom.
Produkcija
Industrijski Na2S se proizvodi redukcijom Na2SO4 ugljenikom, u obliku uglja:[5]
- Na2SO4 + 4 C → Na2S + 4 CO
U laboratoriji, anhidratna so se može pripremiti redukcijom sumpora natrijumom u anhidratnom amonijaku. Alternativno, sumpor se može redukovati natrijumom u suvom THF-u sa katalitičkom količinom naftalena:[6]
- 2 Na + S → Na2S
Reakcije
Proces rastvaranja se može opisati sledećom reakcijom:
- Na2S + H2O → 2Na+ + HS− + OH−
Natrijum sulfid se može oksidovati zagrevanjem do natrijum karbonata i sumpor dioksida:
- 2 Na2S + 3 O2 + 2 CO2 → 2 Na2CO3 + 2 SO2
Nakon tretmana sumporom, se formiraju polisulfidi:
- 2Na2S + S8 → 2 Na2S5
Reference
- ↑ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today 15 (23-24): 1052-7. DOI:10.1016/j.drudis.2010.10.003. PMID 20970519. edit
- ↑ Evan E. Bolton, Yanli Wang, Paul A. Thiessen, Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry 4: 217-241. DOI:10.1016/S1574-1400(08)00012-1.
- ↑ Zintl, E; Harder, A; Dauth, B. (1934). „Gitterstruktur der oxyde, sulfide, selenide und telluride des lithiums, natriums und kaliums”. Zeitschrift für Elektrochemie und Angewandte Physikalische Chemie 40: 588–93.
- ↑ Wells, A.F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. ISBN 0-19-855370-6.
- ↑ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ↑ So, J.-H; Boudjouk, P; Hong, Harry H.; Weber, William P. (1992). „Hexamethyldisilathiane”. Inorganic Syntheses. Inorganic Syntheses 29: 30. DOI:10.1002/9780470132609.ch11. ISBN 978-0-470-13260-9.
- p
- r
- u
NaAlO2 • NaBH3(CN) • NaBH4 • Na2B4O7 10 H2O • NaBr • NaBrO3 • NaCH3COO • NaCFH2COO • NaHCOO • NaCN • NaC6H5CO2 • NaC6H4(OH)CO2 • NaC18H35O2 • NaCl • NaClO • NaClO2 • NaClO3 • NaClO4 • NaF • NaH • NaHCO3 • NaH2PO4 • Na2HPO4 • Na3PO4 • NaHSO3 • NaHSO4 • NaI • NaIO3 • NaIO4 • NaMnO4 • NaNH2 • NaNO2 • NaNO3 • NaN3 • NaOH • NaO2 • NaPO2H2 • NaReO4 • NaSCN • NaSH • NaTcO4 • NaVO3 • Na2CO3 • 2 Na2CO3 3 H2O2 • Na2C2O4 • Na2CrO4 • Na2Cr2O7 • Na2MnO4 • Na2MoO4 • Na2O • Na2O2 • Na2O(UO3)2 • Na2S • Na2SO3 • Na2SO4 • Na2S2O3 • Na2S2O4 • Na2S2O5 • Na2S2O6 • Na2S2O7 • Na2S2O8 • Na2Se • Na2SeO3 • Na2SeO4 • Na2SiO3 • Na2Te • Na2TeO3 • Na2Ti3O7 • Na2U2O7 • NaWO4 • Na2Zn(OH)4 • Na3N • Na3P • Na3VO4 • Na4Fe(CN)6 • Na5P3O10 • NaBiO3







