PH
A pH (pondus hidrogenii, latinul potentia hydrogeni, hidrogénion-kitevő) dimenzió nélküli kémiai mennyiség, mely egy adott oldat kémhatását (savasságát vagy lúgosságát) jellemzi. Híg vizes oldatokban a pH egyenlő az oxóniumion-koncentráció tízes alapú logaritmusának ellentettjével.
vagy egyszerűbben:
(A hidrogénion (H+) a víz autoprotolízisével, vagy a savak ionizációjával keletkezik, de vizes közegben mindig hozzákapcsolódik egy vízmolekulához, és oxóniumion (H3O+) jön létre.)
A víz autoprotolízise, pH
A víz autoprotolízise olyan egyensúlyi reakció, melynek során 10−7 mólnyi vízmolekula ad át protont egy másiknak (1 liter vízben, 25 °C-on):
- Erre az egyensúlyi reakcióra felírható a Kvíz egyensúlyi állandó:
- Kvíz = [H3O+][OH−] = 10−7mol/dm³ · 10−7mol/dm³ = 10−14(mol/dm³)²
- A szögletes zárójellel a megfelelő ionok moláris koncentrációját jelöljük, ennek szokásos mértékegysége: mol/dm³; az SI-mértékegység ezerszerese. 1 dm³ = 1 liter.
- Ebből következik:
- tiszta vízben és semleges kémhatású oldatokban:
- [H3O+] = [OH−] = 10−7 mol/dm³
- pH = −lg10−7 = 7
- Savak és lúgok híg vizes oldatában az egyensúly eltolódik, de a kétféle ion moláris koncentrációjának szorzata (Kvíz) állandó marad:
- savas közegben megnő az oxóniumionok moláris koncentrációja:
- - például egy erős savból készült 0,1 mol/dm³ koncentrációjú oldatban (25 °C-on):
- [H3O+] = 10−1 mol/dm³
- [OH−] = 10−13 mol/dm³
- pH = −lg[H3O+] = −lg10−1 = 1
- tehát [H3O+] > [OH−], vagyis [H3O+] > 10−7 mol/dm³.
- pH < 7
- Savak és lúgok híg vizes oldatában az egyensúly eltolódik, de a kétféle ion moláris koncentrációjának szorzata (Kvíz) állandó marad:
- lúgos közegben lecsökken az oxóniumionok moláris koncentrációja:
- - például egy erős lúgból készült 0,1 mol/dm³ koncentrációjú oldatban (25 °C-on):
- [H3O+] = 10−13 mol/dm³
- [OH−] = 10−1 mol/dm³
- pH = −lg[H3O+] = −lg10−13 = 13
- tehát [H3O+] < [OH−], vagyis [H3O+] < 10−7 mol/dm³.
- pH > 7
Összefoglalva: A tiszta víz pH-értéke 7, ennél kisebb pH-érték savasságot, nagyobb pH-érték pedig lúgosságot jelez.
Ugyanilyen gondolatmenet szerint ki lehet számítani a pOH-t is. Ennek változása ellentétes a pH változásával.

pH-értékek
| Anyag | pH-érték | savas |
|---|---|---|
| Akkumulátorsav (kénsav): H2SO4 | 0-0,5 | |
| Sósav (gyomorsav - üres gyomor) | 1,0–1,5 | |
| Citromsav | 2,4 | |
| Coca-Cola | 2,0–3,0 | |
| Ecetsav | 2,5 | |
| Gyümölcslé (meggy) | 2,7 | |
| Narancslé és almalé | 3,5 | |
| Bor | 4 | |
| Savanyú tej | 4,5 | |
| Sör | 4,5–5,0 | |
| Savas eső | < 5,0 | |
| Kávé | 5,0 | |
| Tea | 5,5 | |
| Eső | 5,6 | |
| Ásványvíz | 6,0 | |
| Tej | 6,5 | semleges |
| Víz (a víz keménységétől függően) | 6,0–8,5 | |
| Emberi nyál | 6,5–7,4 | |
| Vér | 7,4 | lúgos |
| Tengervíz | 7,5–8,4 | |
| Hasnyálmirigy-váladék (bél) | 8,3 | |
| Szappan | 9,0–10,0 | |
| Háztartási ammónia | 11,5 | |
| Oltott mész - Ca(OH)2 | 12,4 | |
| Hipó - fehérítő | 12,5 | |
| Beton | 12,6 | |
| Marónátron - NaOH | 13,5–14 |
pH-mérés
A pH értéket indikátorokkal, vagy digitális pH-mérőkkel lehet meghatározni:
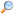 | Bővebben: Sav-bázis indikátor |
 |  |
 |  |  |
Pontos definíció
A pH-ra a fenti képlet csak híg vizes oldatokban igaz. A pH valójában a hidrogénion-aktivitástól függ, ami töményebb oldatokban nem egyenlő a hidrogénion-koncentrációval. Tömény oldatok esetén a pH-t a hidrogénion-aktivitás segítségével fejezzük ki:
A képletben a hidrogénion-aktivitás. A hidrogénion-aktivitást a koncentrációból az aktivitási együttható (, vagy ) segítségével kaphatjuk meg. Az aktivitási együttható egy 0 és 1 közé eső viszonyszám, mely számos tényezőtől, köztük a hidrogénion-koncentrációtól függ.
Kis hidrogénion-koncentráció mellett az aktivitási együttható magas, értéke jó közelítéssel 1. Így híg oldatban a hidrogénion-koncentráció megegyezik a hidrogénion-aktivitással. A pH tehát közvetlenül számolható a koncentrációból.
A pH mértékegységéről
A fenti képletek az ún. szabványos koncentráció mértékegységét tartalmazzák, amely az SI-egységnek ezredrésze: mol/dm³. Ebben további ellentmondás, hogy a koncentrációnál a nevezőben az egész oldat térfogata áll, míg a molalitásnál csak az oldószer tömege kerül a nevezőbe. A Green Book második kiadása egyenértékűként fogadta el kétféle mértékegységgel is (γ± az ionos aktivitási együttható az IUPAC dokumentumban; azonos a fent alkalmazott f jelű fizikai mennyiséggel) :
A törtvonal értelme e képletekben az, hogy a fizikai mennyiség értékét osztjuk a mértékegységével, így annak mérőszámát kapjuk. Aktuálisan ez azt jelentette, hogy a koncentráció és a molalitás mérőszáma azonos, máskülönben nem eredményezhetnének azonos pH-értéket. Ne felejtsük el azt sem, hogy a képletben nem a koncentráció SI-mértékegysége szerepel, hanem annak ezredrésze, aktuálisan: mol/dm³, ami sérti a mértékegységrendszer koherenciáját. A dokumentumok erre a problémára egy másik megoldást is adnak; definiálják a szabványos koncentráció fogalmát a következőképpen:
A harmadik kiadás egyértelműen úgy határoz, hogy a hidrogénion-„koncentráció” mértékegységét a molalitás szabványos mértékegységében mért mérőszámból kell meghatározni. Ennek nagysága . (A vizes oldatok sűrűségének mérőszáma kg/dm³-ben az egyhez közeli érték.) Ebből következően a logaritmus függvény argumentuma 1 mértékegységű szám: , így teljesül az a feltétel, hogy logaritmust csak dimenziómentes mérőszámból szabad számítani. A dokumentum kitér arra is, hogy a molalitás jeléül nem helyes az m betűt használni, mert összetéveszthető a tömeg jelével. Ezért javasolja inkább a b betű használatát.
A Green Book harmadik kiadása[1] a következőképpen határozza meg a pH-t:
Története
A pH fogalmát Søren Peter Lauritz Sørensen (1868–1939) dán biokémikus vezette be,[2] melyet ő még a vizes oldatbeli oxóniumion mol/dm³-ben kifejezett egyensúlyi koncentrációjával ([H3O+]) definiált:
Szobahőmérsékleten (kb. 22 °C-on) 1 dm³ vegytiszta víz, autoprotolízisének köszönhetően dinamikus egyensúlyban 10−7 mol hidrogéniont (H+ vagy H3O+) és – értelemszerűen – ugyanennyi hidroxidiont (OH−) tartalmaz:
Ekkor tehát Sørensen szerint a pH-értéke 7. Ez tekinthető a semleges kémhatásnak. Ennél kisebb pH-érték, vagyis a hidroxidionokhoz képest nagyobb hidrogénion koncentráció savasságot, nagyobb pH-érték pedig lúgosságot jelez.
Nem vizes oldatokban
A pH fogalma jellegéből adódóan más egyéb autoprotolízisre hajlamos kémiai rendszerekre is kiterjeszthető. Például a vegytiszta etanol (C2H5OH) szobahőmérsékleten és ugyancsak dinamikus egyensúlyban 10−10 mol protonált és ugyanennyi deprotonált molekulát tartalmaz dm³-enként. Ekkor a semleges kémhatáshoz tartozó pH-érték 10.
Jegyzetek
Források
- Acids, Bases and pH (A City University of New York honlapján)
- Activities of hydrogen ion Archiválva 2008. április 24-i dátummal a Wayback Machine-ben (A Stetson University honlapján)
- Kémhatás, pH
- https://web.archive.org/web/20090228061714/http://celebrate.digitalbrain.com/celebrate/community/celebrate/resources/Hungary/kemia/A%20kemhatas/home/
- https://web.archive.org/web/20101224102826/http://www.sulinet.hu/tart/fncikk/Kidb/0/24833/index.html
- http://termtud.akg.hu/okt/7/viz/9kemhatas.htm
- http://termtud.akg.hu/okt/7/viz/9kemhatas.htm
- Online pH calculator
- Viz pH teszt, YouTube
Kapcsolódó szócikkek
 Kémiaportál • összefoglaló, színes tartalomajánló lap
Kémiaportál • összefoglaló, színes tartalomajánló lap
![{\displaystyle \mathrm {pH=-\log _{10}[H_{3}O^{+}]=-\lg[H_{3}O^{+}]\!} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/e631ef0ac4b1ea1f6a8a2dd2037bf29c4dad68dd)
![{\displaystyle \mathrm {pH} =-\log _{10}\mathrm {[H^{+}]} =-\lg \mathrm {[H^{+}]} \!}](https://wikimedia.org/api/rest_v1/media/math/render/svg/243f87e6c0a2c275b2c550623c2c60990c35d8a8)





![{\displaystyle \mathrm {a} _{\mathrm {H^{+}} }=f\cdot \mathrm {[H^{+}]} \!}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d7b7e16e0d637c4479b94d3308f1c86160b84f31)
![{\displaystyle \mathrm {pH} =-\log _{10}(f\cdot \mathrm {[H^{+}]} )\!}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a75a3059dc6862675bd62bd84b9d3e7a7414c823)

![{\displaystyle \mathrm {pH} =-\log _{10}(f\cdot \mathrm {[H^{+}]} )=-\log _{10}(1\cdot \mathrm {[H^{+}]} )\!}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e329472e5cd343bf2c4254469892bb73d97e1cde)
![{\displaystyle pH=-\mathrm {l} g\left[\gamma _{\pm }\centerdot c(H^{+})/(\mathrm {mol\ dm^{-3}} )\right]\pm 0,02}](https://wikimedia.org/api/rest_v1/media/math/render/svg/32237b0b23daa502745adc61e89f9eb11e5e27ea)
![{\displaystyle pH=-\mathrm {l} g\left[\gamma _{\pm }\centerdot m(H^{+})/(\mathrm {mol\ kg^{-1}} )\right]\pm 0,02}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5858bf2d8dde50217657ee71212d8227a00d77ba)




![{\displaystyle \mathrm {pH=-\log _{10}\left({\frac {[H_{3}O^{+}]}{1{\frac {mol}{dm^{3}}}}}\right)} .\!}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fc4d580478c2cff899528a8864e2f52f266350dd)

![{\displaystyle \mathrm {[H_{3}O^{+}]=[OH^{-}]=10^{-7}{\frac {mol}{dm^{3}}}} \!}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7ca6d8265bfa349e69b25893f904e3cb5afbadcd)












